Послідовність сигналів стресу серед спеціалізованих клітин, які очищають мозок, нарешті може пояснити, чому деякі імунні реакції викликають значну нервову дегенерацію, що призводить до втрати пам’яті, здатності до судження та усвідомлення, характерних для хвороби Альцгеймера.
Блокування цього шляху в мозку мишей із моделлю хвороби Альцгеймера запобігло пошкодженню синапсів та зменшило накопичення потенційно токсичних тау-білків – обидва ці фактори є ознаками захворювання.
Дослідники з Університету Міста Нью-Йорк (CUNY) виявили, що цей шлях – інтегрована відповідь на стрес (ISR) – змушує імунні клітини мозку, відомі як мікроглії, переходити в “темний” стан, у якому вони починають шкодити мозку замість користі.
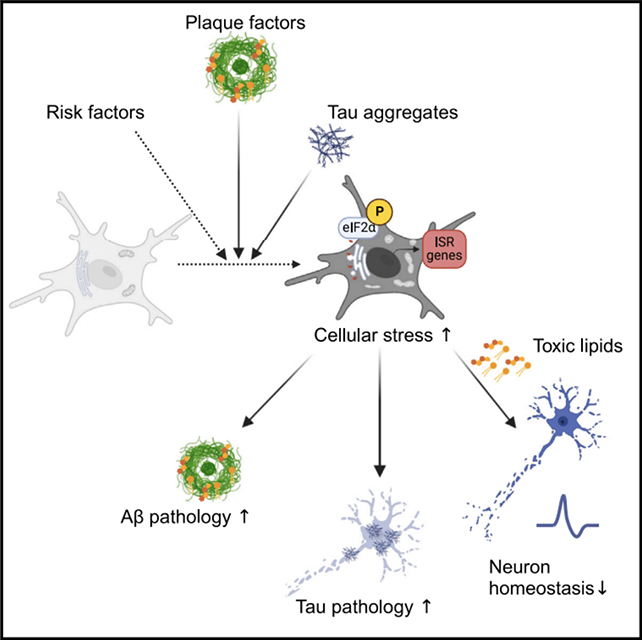
Дослідники вивчили вплив стресу на клітини мікроглії. (Flury et al., Neuron, 2024)
“Ми прагнули з’ясувати, які саме мікроглії завдають шкоди при хворобі Альцгеймера та як їх можна терапевтично цілеспрямовано нейтралізувати,” пояснює нейробіолог з CUNY Пінар Аята.
“Ми визначили новий нейродегенеративний фенотип мікроглій при хворобі Альцгеймера, що характеризується сигнальним шляхом, пов’язаним зі стресом.”
Імунні клітини, які діють неконтрольовано, раніше вже були пов’язані з хворобою Альцгеймера. Команда використала метод електронної мікроскопії, щоб ідентифікувати накопичення темних мікроглій у мозку людей із цим захворюванням.
Дослідники виявили приблизно вдвічі більше стресованих мікроглій у мозку людей із хворобою Альцгеймера порівняно зі здоровими мозками. Подальші дослідження показали, що шлях ISR спричиняє вивільнення темними мікрогліями шкідливих ліпідів у тканини мозку.
Саме ці руйнівні жири спричиняли пошкодження синапсів та порушення нейронної комунікації, які спостерігаються при хворобі Альцгеймера.
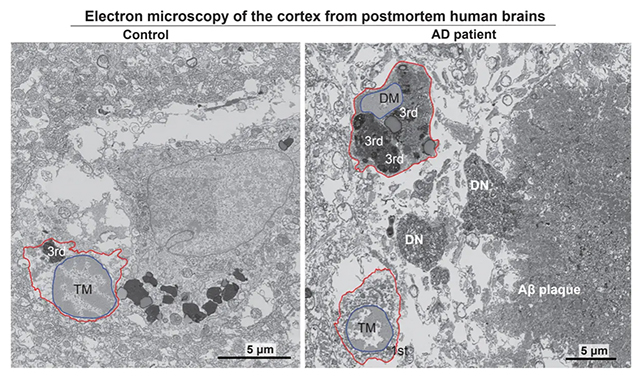
Сканування мозку використовувалося для виявлення темних мікроглій. (Flury et al., Neuron, 2024)
Як це часто буває у дослідженнях хвороби Альцгеймера, краще розуміння роботи захворювання може надати вченим більше ідей для лікування. Якщо методи блокування ISR зможуть безпечно та ефективно працювати у людей, вони потенційно зможуть уповільнити хаос, який хвороба Альцгеймера спричиняє в нашому мозку.
“Ці висновки виявляють критичний зв’язок між клітинним стресом та нейротоксичними ефектами мікроглій при хворобі Альцгеймера,” зазначає молекулярний біолог Анна Флюрі з CUNY.
“Цілеспрямоване лікування цього шляху може відкрити нові можливості для терапії, зокрема зупинення вироблення токсичних ліпідів або запобігання активації шкідливих фенотипів мікроглій.”
Команда зауважила, що дисфункції білків, які часто стають причиною деменції, можуть ініціювати шлях ISR, що означає, що ці сигнали є як результатом хвороби Альцгеймера, так і причиною її подальшого прогресування.
Подальші дослідження мають прояснити цей зв’язок, тепер, коли ми краще розуміємо, як шлях ISR та темні мікроглії діють у мозку. Це може відкрити нові підходи до лікування.
“Такі методи терапії можуть значно уповільнити або навіть зупинити прогресування хвороби Альцгеймера, даючи надію мільйонам пацієнтів та їхнім сім’ям,” додає нейробіолог Лін Альджаюсі з CUNY.
Дослідження опубліковане в журналі Neuron.
